现在的位置:主页 > 综合新闻 >
Nature子刊-综述巨著| 当肿瘤遇上耐药,我们都采
【作者】:网站采编【关键词】:【摘要】:写在前面 分子靶向治疗,是在细胞分子水平上,针对已经明确的致癌位点,来设计相应的治疗药物,药物进入体内会特异地选择致癌位点来相结合发生作用,使肿瘤细胞特异性死亡,相
写在前面
分子靶向治疗,是在细胞分子水平上,针对已经明确的致癌位点,来设计相应的治疗药物,药物进入体内会特异地选择致癌位点来相结合发生作用,使肿瘤细胞特异性死亡,相比较传统的化疗药物,靶向药物不会波及正常组织细胞,所以分子靶向治疗又被称为“生物导弹”。自第一个靶向药格列卫取得巨大成功以来,靶向癌症靶点的药物已经玲琅满目,一些癌症的治疗取得了巨大成效,给患者带来了福音以及希望。

但是道高一尺,魔高一丈。狡猾的癌细胞岂能是任人刀俎的鱼肉。产生耐药性是它们抗争的最直接的表现。比如非小细胞肺癌的治疗,由于癌细胞的靶点产生耐药突变,不得不使靶向药物升级换代,目前为止已经经历了三代药物的更迭,不幸的是,第三代针对T790M突变药物奥希替尼也产生了突变,目前面临没有新的靶向药物更换的尴尬局面。再比如费城染色体易位的慢性骨髓性白血病,在经历第一代靶向神药格列卫突变后,第二代,第三代的药物应用而生,比如尼洛替尼,氟马替尼等。
其实除了靶点突变的耐药机制以外,癌细胞进化出了各种神奇的耐药机制。比如表达排出药物的泵系统,俗称吃了吐。还有会进化出减毒的机制,让毒性的药物变成无毒的药物,以及改变了自身的繁殖方式等等都会产生对当前药物的抵抗性。最近一篇Science文章指出肿瘤在进行化疗时会累积DNA损伤,并会增加基因突变的概率,最终少部分肿瘤细胞会被筛选出来从而进化出各种耐药性。

当癌症靶向药物遭遇耐药后,科学家也并不是束手无策,病人也更不会束手就擒,针对耐药性本篇文章总结了常见五种针对耐药性的策略。下面将一一进行解读。
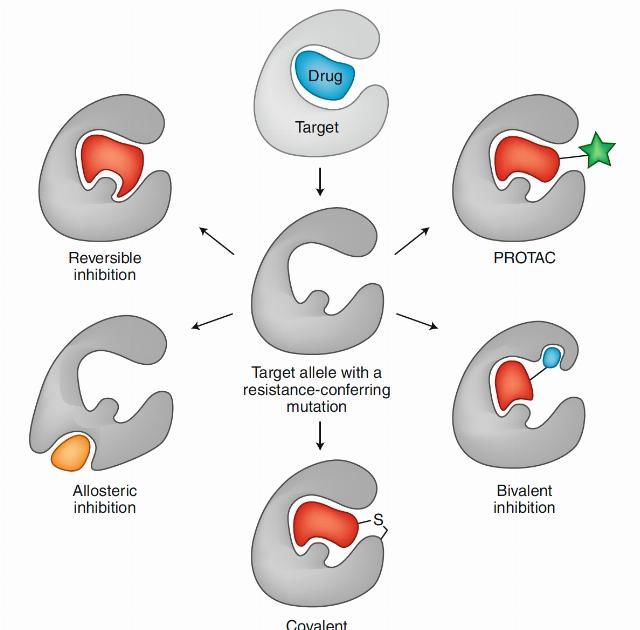
设计具有独特结合模式的抑制剂
ALK阳性的肺癌患者治疗要首选靶向药,也就是ALK激酶抑制剂。2011年,克唑替尼成为第一个ALK抑制剂,获得FDA批准用于ALK阳性的NSCLC的一线治疗,也问世中国临床多年。虽然有效,但许多患者在治疗约1年后通常会发生耐药。针对该突变,研发出第二代的药物,2017年FDA批准了能够替代克唑替尼的ALK抑制剂-色瑞替尼。但后续由于检测到ALK基因继发突变,该突变提示对第二代靶向药ceritinib不敏感,但却是第三代靶向药lorlatinib的有效靶点。Lorlatinib治疗持续8个月有效后,癌症复发,基因检测发现,不仅有ALK C1156Y突变,还出现了新的ALK L1198F突变。但是有意思的是,L1198F突变会介导产生lorlatinib耐药,但却可以增强第一代ALK靶向药crizotinib的作用,这种增效作用足以胜过原有的C1156Y突变相关耐药。所以,患者又从第三代lorlatinib及时换回到第一代crizotinib治疗,收获了较好的效果。
著名医学杂志《New England Journal of Medicine》刊登了这个经典的案例,所以在全程ALK靶向药治疗中,一旦发生耐药则基于耐药基因实时监测指导下,从第一代吃到第三代,再换回吃第一代,通过轮换靶向药成功克服了耐药。
设计共价结合模式的抑制剂
过去十年里,NSCLC 治疗方案中最显著的改变可能就是 EGFR 酪氨酸激酶抑制剂用于具有 EGFR 靶向性驱动突变患者一线治疗。其中设计开发的共价抑制剂是一大亮点和突破。以EGFR为靶标的第一代非共价抑制剂,如吉非替尼, 厄洛替尼。对治疗EGFR~突变的NSCLC患者有良好的疗效。然而,在接受EGFR抑制剂治疗8-14个月后,约60%的患者发生了T790M突变并产生耐药性。
以前大部分的抑制剂是可逆的,科学家脑洞大开,是否可以利用激酶中具有亲核功能的基团比如巯基,设计含有亲电基团的共价抑制剂呢?于是第二代共价EGFR抑制剂横空出世,如阿法替尼和达克替尼,被开发用于治疗EGFR~突变和T790M耐药突变的NSCLC患者。但这些抑制剂对EGFR~突变型和野生型EGFR激酶之间缺乏选择性 ,因而会产生较强的毒副作用。2018年,FDA批准了第三代共价EGFR抑制剂,如奥希替尼,对EGFR~活性较弱,而对EGFR~具有较高的活性及选择性,减轻了毒副作用。然而,接受其治疗的三分之一患者出现了C797S突变并产生耐药性,也就是把能够发生共价反应的巯基突变成了羟基。目前针对该突变尚未有合适的靶向药,如果产生耐药了,患者可能就要考虑传统的化疗药物。
设计变构结合模式的抑制剂
变构效应长期以来都被应用于调节正构效应难以靶向的药物靶标,近年来,它被逐步应用到蛋白相互作用的调节当中。通过变构效应调节蛋白相互作用已经成为创新药物研发领域的热点。变构剂保守性低于ATP结合位点,选择性高,并具有额外的有利性质。当靶点具有双重结合位点时,在单独给药产生耐药突变后,可选择另外一个位点的靶向药物,如上图a,b. 如果靶向两个结合位点会怎么样呢?上图c所示,双重抑制会不会产生1+1>2的效果,会不会克服耐药性的产生呢?
文章来源:《肿瘤药学》 网址: http://www.zlyxzz.cn/zonghexinwen/2020/0912/488.html

